
Inhoud
- Lichamelijk examen en geschiedenis
- Bloedtesten
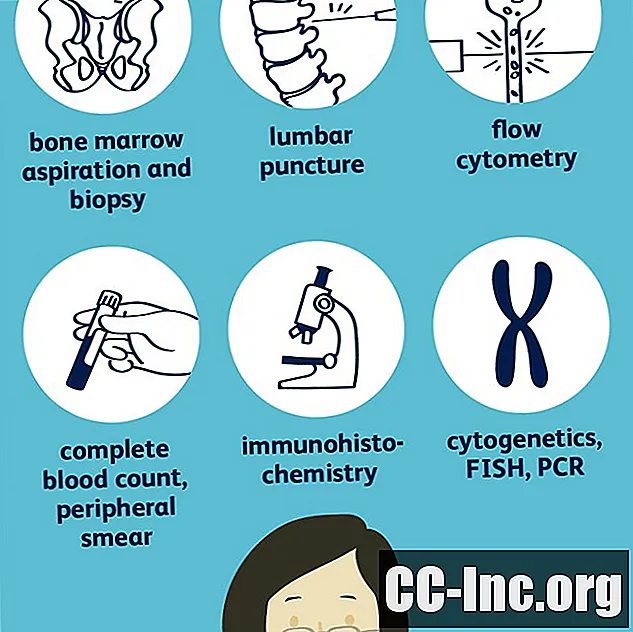
- Beenmergaspiratie en biopsie
- Cytochemie
- Chromosoom- en genstudies
- Andere procedures
- In beeld brengen
- Differentiële diagnose
- Enscenering
Vervolgens worden aanvullende tests uitgevoerd om te zoeken naar oppervlaktemarkers op de cellen (flowcytometrie) en genetische veranderingen (cytogenetische tests). Bij sommige leukemieën kan ook een lumbaalpunctie (ruggenprik) of een lymfeklierbiopsie worden bekeken.
De kanker, indien ontdekt, wordt vervolgens geënsceneerd op basis van factoren zoals symptomen, het subtype leukemie, het aantal abnormale cellen in het bloed of beenmerg, en meer.
Als we het hebben over de diagnose van leukemie, is het belangrijk om te onthouden dat leukemie niet één ziekte of zelfs maar vier ziekten is. Er zijn eerder veel verschillende variaties.
Twee leukemieën die onder de microscoop identiek lijken, kunnen zich heel verschillend gedragen, en sommige van de onderstaande tests kunnen helpen om enkele verschillen te onderscheiden.
Lichamelijk examen en geschiedenis
De anamnese en het fysieke zijn het uitgangspunt bij de diagnose van leukemie en wat artsen vaak ertoe aanzet om verdere studies te bestellen, maar ze kunnen niet alleen worden gebruikt om de diagnose te stellen.
Als leukemie wordt vermoed, zal uw arts vragen stellen over eventuele symptomen van leukemie en naar risicofactoren voor de ziekte die u mogelijk heeft. Een lichamelijk onderzoek kan tekenen aan het licht brengen dat leukemie aanwezig kan zijn, zoals zwelling van lymfeklieren, bleke huid of blauwe plekken. Hoewel opmerkelijk indien aanwezig, kunnen ze wijzen op andere problemen. Uw arts zal rekening houden met hun aanwezigheid.
Discussiegids voor leukemie-artsen
Download onze afdrukbare gids voor uw volgende doktersafspraak om u te helpen de juiste vragen te stellen.

Bloedtesten
Zowel een volledig bloedbeeld als een perifeer uitstrijkje, eenvoudige bloedonderzoeken, kunnen belangrijke aanwijzingen geven over de diagnose en het type leukemie en dienen als leidraad voor verdere evaluatie.
Voltooi het aantal bloedcellen en het uitstrijkje van perifeer bloed
EENvolledig bloedbeeld (CBC) meet het aantal van de belangrijkste typen bloedcellen die door het beenmerg worden aangemaakt: de witte bloedcellen, rode bloedcellen en bloedplaatjes. De CBC kan ook resultaten opleveren die belangrijke informatie over deze cellen doorgeven, bijvoorbeeld of de rode bloedcellen groot of klein zijn.
Hoewel er bij leukemie vaak een toename van witte bloedcellen is, is er bij acute leukemie soms een verminderen in alle typen bloedcellen, een aandoening die pancytopenie wordt genoemd.
EEN perifere uitstrijkje is een zeer belangrijke test bij het overwegen van de diagnose leukemie. Bij een uitstrijkje perifeer wordt een bloedmonster op een objectglaasje uitgespreid en wordt kleurstof toegevoegd. Het uitstrijkje wordt vervolgens onder een microscoop beoordeeld.
Een CBC kan bepalen of het aantal witte bloedcellen laag of hoog is, maar geeft niet genoeg informatie over het type witte bloedcellen dat wordt verhoogd of verlaagd.
Het vertelt een arts ook niet of er onrijpe witte bloedcellen zijn die "ontploffingen" worden genoemd in de perifere bloedcellen die normaal gesproken alleen in significante aantallen in het beenmerg worden aangetroffen.
Een uitstrijkje van de rand kan deze vragen beantwoorden door technici en artsen in staat te stellen de cellen direct onder de microscoop te observeren.
Typische bevindingen (deze kunnen variëren) op een CBC en bloeduitstrijkje voor de vier belangrijkste soorten leukemie zijn:
Ziekte | CBC-resultaten | Resultaten bloeduitstrijkjes |
Acute myelogene leukemie (AML) | Minder dan normale hoeveelheden rode bloedcellen en bloedplaatjes | Veel onrijpe witte bloedcellen, en soms de aanwezigheid van Auer-staafjes |
Acute lymfatische leukemie (ALL) | Minder dan normale hoeveelheden rode bloedcellen en bloedplaatjes | Veel onrijpe witte bloedcellen |
Chronische myelogene leukemie (CML) | • Het aantal rode bloedcellen kan hoog zijn en het aantal bloedplaatjes kan hoog of laag zijn | • Kan enkele onvolgroeide witte bloedcellen vertonen |
Chronische lymfatische leukemie (CLL) | • Rode bloedcellen en bloedplaatjes kunnen al dan niet verminderd zijn | • Weinig of geen onrijpe witte bloedcellen |
Sommige van de hieronder besproken tests, zoals cytochemie, kunnen ook op perifeer bloed worden uitgevoerd.
Beenmergaspiratie en biopsie
Bij de meeste soorten leukemie zijn bloedonderzoeken niet voldoende om de ziekte definitief te diagnosticeren, en worden beenmergaspiratie en biopsie uitgevoerd. (Bij CLL kan de diagnose soms worden gesteld op basis van de bloedonderzoeken hierboven, maar een beenmerg kan nog steeds nuttig zijn om te bepalen hoe ver de kanker is.) Het beenmerg is de bron van de kankercellen bij leukemie en alle bloedcellen gevonden in het perifere bloed.
Bij een beenmergaspiratie wordt een lange, dunne naald in het beenmerg in de heup (of soms het borstbeen) ingebracht na plaatselijk de huid te verdoven met lidocaïne. Nadat een monster van het beenmerg is opgezogen, wordt ook een biopsiemonster genomen.
In normaal beenmerg zijn tussen 1 procent en 5 procent van de cellen blastcellen, of de onrijpe witte bloedcellen die rijpen tot de cellen die normaal in het bloed worden aangetroffen.
De diagnose ALL kan worden gesteld als ten minste 20% van de cellen blasten (lymfoblasten) zijn. Met AML kan een diagnose worden gesteld als er minder dan 20% blasten (myeloblasten) zijn als er ook een specifieke chromosoomverandering wordt gevonden.
Naast het aantal verschillende cellen dat in het beenmerg aanwezig is, kijken artsen ook naar het patroon van de cellen. Bij CLL is de prognose van de ziekte bijvoorbeeld beter als de kankercellen in groepen worden aangetroffen (nodulair of interstitieel patroon) dan wanneer ze diffuus verspreid over het beenmerg worden aangetroffen.
De verhouding tussen leukemiecellen en gezonde bloedvormende cellen kan significant zijn in het diagnostische proces.
Cytochemie
Cytochemie kijkt naar hoe de cellen in het beenmerg bepaalde vlekken opnemen en kan nuttig zijn om ALL van AML te onderscheiden. Tests kunnen zowel flowcytometrie als immunohistochemie omvatten.
In flowcytometrieworden de beenmergcellen (of perifere bloedcellen) bedekt met antilichamen om de aanwezigheid van bepaalde eiwitten op het oppervlak van de cellen te zoeken. De antilichamen blijven aan deze eiwitten kleven en kunnen worden gedetecteerd door het licht dat ze afgeven wanneer een laser wordt geïntroduceerd.
Immunohistochemie is vergelijkbaar, maar in plaats van een laser te gebruiken om te zoeken naar licht dat wordt afgegeven door met antilichamen gemarkeerde eiwitten, kunnen ze onder de microscoop worden gezien als gevolg van een kleurverandering.
Dit proces van het zoeken naar unieke eiwitten op het oppervlak van cellen wordt aangeduid als immunofenotypering. In de genetica verwijst genotype naar de kenmerken van een gen, terwijl fenotype fysieke kenmerken beschrijft (zoals blauwe ogen). Verschillende soorten leukemie verschillen in deze fenotypes.
Bij acute leukemieën (zowel ALL als AML) kunnen deze onderzoeken nuttig zijn bij het bepalen van het subtype van de ziekte, en bij ALL kunnen ze bepalen of de leukemie T-cellen of B-cellen betreft.
Bovendien kunnen deze tests zeer nuttig zijn bij het bevestigen van de diagnose CLL (door te zoeken naar eiwitten genaamd ZAP-70 en CD38).
Flowcytometrie kan ook worden gebruikt om de hoeveelheid DNA in leukemiecellen te bepalen, wat nuttig kan zijn bij het plannen van de behandeling. ALLE cellen die meer DNA hebben dan een gemiddelde cel, reageren doorgaans beter op chemotherapie.
Chromosoom- en genstudies
Leukemiecellen hebben vaak veranderingen in de chromosomen of genen die in het DNA van elke cel worden aangetroffen. Elk van onze cellen heeft normaal gesproken 46 chromosomen, 23 van elke ouder, die veel genen bevatten. Sommige onderzoeken kijken primair naar chromosomale veranderingen, terwijl andere kijken naar veranderingen in specifieke genen.
Cytogenetica
Cytogenetica omvat het bekijken van de chromosomen van kankercellen onder de microscoop en het zoeken naar afwijkingen.
Vanwege de methode waarmee dit wordt gedaan (de kankercellen hebben tijd nodig om in het laboratorium te worden gekweekt nadat ze zijn opgehaald), zijn de resultaten van deze onderzoeken vaak pas twee tot drie weken na een beenmergbiopsie beschikbaar.
Chromosomale veranderingen die kunnen worden waargenomen in de leukemiecellen zijn onder meer:
- Deleties: er ontbreekt een deel van een chromosoom.
- Translocaties: stukken van twee chromosomen worden uitgewisseld. Dit kan een volledige uitwisseling zijn, waarbij stukjes DNA eenvoudig tussen twee chromosomen worden uitgewisseld, of een gedeeltelijke. DNA kan bijvoorbeeld worden uitgewisseld tussen chromosoom 9 en 22. Chromosoomtranslocaties komen zeer vaak voor bij leukemie en komen voor bij tot 50 procent van deze kankers.
- Inversie: Een deel van een chromosoom blijft aanwezig, maar wordt omgedraaid (alsof een stukje van een puzzel wordt verwijderd en teruggeplaatst, maar dan naar achteren).
- Toevoeging of duplicatie: er worden extra kopieën van een geheel of een deel van een chromosoom gevonden.
- Trisomie: er zijn drie exemplaren van een van de chromosomen in plaats van twee.
Naast het verder definiëren van het type leukemie, kan cytogenetica helpen bij het plannen van de behandeling. In ALL reageren leukemiecellen met meer dan 50 chromosomen bijvoorbeeld beter op behandeling.
Fluorescerende in situ hybridisatie (FISH)
Fluorescerende in situ hybridisatie (FISH) is een procedure waarbij speciale kleurstoffen worden gebruikt om te zoeken naar veranderingen in chromosomen die niet onder de microscoop kunnen worden gedetecteerd, of veranderingen in specifieke genen.
Bij chronische myeloïde leukemie (CML) kan deze test zoeken stukken van het BCR / ABL1-fusiegen (Philadelphia-chromosoom).
Ongeveer 95% van de mensen met CML zal dit verkorte chromosoom 22 hebben, maar de andere 5% zal bij verder testen nog steeds het abnormale BCR / ABL1-fusiegen hebben. Het Philadelphia-chromosoom is ook een belangrijke bevinding bij ALL.
Bij CLL is cytogenetica minder nuttig, en FISH en PCR zijn belangrijker bij het vinden van genetische veranderingen.Er zijn veel genetische afwijkingen die in deze onderzoeken kunnen worden gezien, waaronder deleties in de lange arm van chromosoom 13 (bij de helft van de mensen met de ziekte), een extra kopie van chromosoom 12 (trisomie 12), deleties in de 17e en 11e chromosoom en specifieke mutaties in genen zoals NOTCH1, SF3B1 en meer.
Polymerase-kettingreactie (PCR)
Net als FISH kan polymerasekettingreactie (PCR) veranderingen in chromosomen en genen vinden die niet zichtbaar zijn via cytogenetica. PCR is ook nuttig bij het vinden van veranderingen die in slechts enkele, maar niet alle, kankercellen aanwezig zijn.
PCR is erg gevoelig voor het vinden van het BCR / ABL-gen, zelfs als andere tekenen van CML niet worden gevonden bij chromosoomtesten.
Andere procedures
Naast het evalueren van witte bloedcellen in het bloed en het beenmerg, worden soms andere procedures uitgevoerd.
Lumbaalpunctie (Spinal Tap)
Bij sommige soorten leukemie kan een ruggenprik (lumbaalpunctie) worden uitgevoerd om te zoeken naar de aanwezigheid van leukemiecellen die zich hebben verspreid in de vloeistof rondom de hersenen en het ruggenmerg. Het kan ook worden gedaan voor mensen met ALL. als mensen met AML die neurologische symptomen hebben die deze verspreiding suggereren.
Bij een lumbaalpunctie ligt een persoon op zijn zij op een tafel met de knieën omhoog en het hoofd naar beneden. Na het reinigen en verdoven van het gebied, steekt een arts een lange dunne naald in de onderrug, tussen de wervels en in de ruimte rond het ruggenmerg. Vloeistof wordt vervolgens onttrokken en naar een patholoog gestuurd om te worden geanalyseerd.
Lymfeklierbiopsie
Lymfeklierbiopsieën, waarbij een deel of de hele lymfeklier wordt verwijderd, worden niet vaak gedaan bij leukemie.Een lymfeklierbiopsie kan worden gedaan met CLL als er grote lymfeklieren aanwezig zijn, of als men denkt dat CLL mogelijk is omgezet in een lymfoom.
In beeld brengen
Beeldvormingstests worden meestal niet gebruikt als een diagnostische methode voor leukemie, omdat bloedgerelateerde kankers zoals leukemie niet vaak tumoren vormen. Het kan echter nuttig zijn bij het stageren van sommige leukemieën, zoals CLL.
Röntgenstralen
Röntgenfoto's, zoals een thoraxfoto of botröntgenfoto, worden niet gebruikt om leukemie te diagnosticeren, maar kunnen de eerste tekenen geven dat er iets mis is. Een röntgenfoto kan vergroting van lymfeklieren of dunner worden van botten (osteopenie) aantonen.
Computertomografie (CT-scan)
Een CT-scan maakt gebruik van een reeks röntgenfoto's om een driedimensionaal beeld van de binnenkant van het lichaam te maken. CT kan nuttig zijn bij het kijken naar knooppunten in de borst of andere delen van het lichaam, evenals bij het opmerken van vergroting van de milt of lever.
Magnetische resonantiebeeldvorming (MRI)
Een MRI maakt gebruik van magneten om een beeld te krijgen van de binnenkant van het lichaam en bevat geen straling. Het kan nuttig zijn bij leukemieën waarbij de hersenen of het ruggenmerg betrokken zijn.
Positron-emissietomografie (PET / CT of PET / MRI)
Bij een PET-scan wordt radioactieve glucose in het lichaam geïnjecteerd, waar het wordt opgenomen door cellen die metabolisch actiever zijn (zoals kankercellen). PET is nuttiger bij solide tumoren dan bij leukemie, maar kan nuttig zijn bij sommige chronische leukemieën, vooral als er bezorgdheid bestaat over de transformatie naar een lymfoom.
Differentiële diagnose
Er zijn enkele ziekten die, althans bij de eerste tests, op leukemie kunnen lijken. Enkele hiervan zijn:
- Bepaalde virale infecties: het Epstein-Barr-virus (de oorzaak van infectieuze mononucleosis), cytomegalovirus en HIV kunnen bijvoorbeeld een verhoogd aantal atypische lymfocyten veroorzaken bij bloedonderzoeken.
- Myelodysplastische syndromen: dit zijn ziekten van het beenmerg die een voorliefde hebben om zich te ontwikkelen tot AML en worden soms preleukemie genoemd.
- Myeloproliferatieve aandoeningen: aandoeningen zoals polycythaemia vera, essentiële trombocytose, primaire myelofibrose en meer kunnen lijken op leukemie voorafgaand aan de uitvoering van de diepgaande testmethoden hierboven.
- Aplastische anemie: een aandoening waarbij het beenmerg stopt met het aanmaken van alle soorten bloedcellen.
Enscenering
Zodra leukemie is bevestigd, moet deze worden geënsceneerd. Staging verwijst naar het systeem dat door artsen wordt gebruikt om een kanker te categoriseren. Door het stadium van kanker in het algemeen te bepalen, kunnen artsen de meest geschikte behandeling kiezen en de prognose van de ziekte inschatten.
De stadiëring verschilt tussen de verschillende soorten leukemie. Aangezien veel leukemieën geen vaste massa vormen, is de stadiëring (met uitzondering van CLL) heel anders dan die van solide tumoren zoals borstkanker of longkanker.
Bij het toewijzen van een stadium kan een aantal onderzoeken in overweging worden genomen, zoals het aantal onrijpe witte bloedcellen dat in het bloed of beenmerg wordt aangetroffen, tumormarkers, chromosoomonderzoeken en meer.
Bij het bekijken van stadiëring is het opnieuw belangrijk op te merken dat leukemie een breed scala aan ziekten is. Twee mensen met dezelfde soort leukemie en hetzelfde stadium kunnen zeer verschillende reacties op therapie hebben, evenals verschillende prognoses.
Chronische lymfatische leukemie (CLL)
Voor chronische lymfatische leukemie zijn er een aantal verschillende stadiëringssystemen die kunnen worden gebruikt. Het meest voorkomende is het Rai-systeem. In dit systeem krijgen leukemieën een stadium tussen stadium 0 en stadium 4 op basis van de aanwezigheid van verschillende bevindingen:
- Hoge aantallen lymfocyten
- Vergrote lymfeklieren
- Een vergrote lever en / of milt
- Bloedarmoede
- Laag aantal bloedplaatjes
Op basis van deze stadia worden de kankers vervolgens onderverdeeld in categorieën met een laag, gemiddeld en hoog risico.
Het Binet-systeem dat in Europa wordt gebruikt, verdeelt deze leukemieën daarentegen in slechts drie fasen:
- Stadium A: minder dan 3 lymfeklieren
- Stadium B: meer dan 3 aangetaste lymfeklieren
- Stadium C: elk aantal lymfeklieren, maar gecombineerd met bloedarmoede of een laag aantal bloedplaatjes.
Acute lymfatische leukemie (ALL)
Voor acute lymfatische leukemie, stadiëring is anders, aangezien de ziekte geen tumormassa's vormt die zich incrementeel vanaf een oorspronkelijke tumor uitstrekken.
ALLEN zullen zich waarschijnlijk verspreiden naar andere organen, zelfs voordat het wordt gedetecteerd, dus in plaats van traditionele stadiëringsmethoden te gebruiken, houden artsen vaak rekening met het subtype ALL en de leeftijd van de persoon.
Dit omvat meestal cytogenetische tests, flowcytometrie en andere laboratoriumtests.
In plaats van stadia te gebruiken (die in het verleden werden gebruikt, zijn grotendeels verouderd), wordt ALL vaker bepaald door de "fasen" van de ziekte. Deze omvatten:
- Onbehandeld ALL
- ALLEN in remissie
- Minimale restziekte
- Vuurvaste ALL
- Recidiverende (terugkerende) ALL
Acute myelogene leukemie (AML)
Net als bij ALL wordt acute myeloïde leukemie meestal pas ontdekt als het zich heeft verspreid naar andere organen, en daarom is traditionele kankerstadiëring niet van toepassing. De stadiëring wordt bepaald door kenmerken zoals het subtype van de leukemie, de leeftijd van een persoon en meer.
Een ouder stadiëringssysteem, de Frans-Amerikaans-Britse (FAB) classificatie, classificeerde AML in acht subtypen, M0 tot en met M7, op basis van het uiterlijk van de cellen onder de microscoop.
De Wereldgezondheidsorganisatie (WHO) heeft een ander systeem voor AML-stadiëring ontwikkeld in de hoop de prognose van de ziekte beter te kunnen voorspellen.
In dit systeem worden deze leukemieën onderscheiden door kenmerken zoals chromosomale afwijkingen in de cellen (sommige chromosoomveranderingen worden geassocieerd met een beter dan gemiddelde prognose, terwijl andere geassocieerd zijn met slechtere resultaten), ongeacht of de kanker is ontstaan na eerdere chemotherapie of straling (secundaire kankers), die verband houden met het syndroom van Down, en meer.
Chronische myelogene leukemie (CML)
Bij chronische myeloïde leukemie is de aanwezigheid van een verhoogd aantal volwassen cellen die tot de myeloïde lijn behoren (zoals neutrofielen) gebruikelijk. De stadiëring wordt bepaald op basis van het aantal onrijpe myeloïde cellen in verschillende stadia van rijping:
- Chronische fase: in dit vroegste stadium zijn er minder dan 10 procent ontploffingen in het bloed of beenmerg en zijn de symptomen mild of afwezig. Mensen in de chronische fase van CML reageren doorgaans goed op de behandeling.
- Versnelde fase: in de volgende fase zijn 10 tot 20 procent van de cellen in het bloed of beenmerg ontploffingen. Symptomen worden meer uitgesproken, met name koorts en gewichtsverlies. Testen kunnen naast het Philadelphia-chromosoom nieuwe chromosomale veranderingen aan het licht brengen. Mensen in de versnelde fase van CML reageren mogelijk niet op de behandeling.
- Blastfase (agressieve fase): in de explosiefase van CML zijn meer dan 20 procent van de cellen in het bloed of beenmerg ontploffingen, en blastcellen kunnen zich ook verspreiden naar delen van het lichaam buiten het beenmerg. Symptomen tijdens deze fase zijn vermoeidheid, koorts en een vergrote milt (blastcrisis).